Batterien
Die Verbreitung der elektrischen Uhr war immer stark verknüpft mit der Verfügbarkeit elektrischer Energie. Lange Zeit gab es kein oder kein zuverlässiges öffentliches Stromnetz, so dass man auf Batterien als Stromlieferanten angewiesen war. Auch bei der Einführung der elektrischen Armbanduhr Ende der 50er Jahre, musste als eines der Hauptprobleme eine Batterie in Form einer Knopfzelle entwickelt werden. Die Entwicklung der elektrischen Uhr lief also immer parallel zur Entwicklung von passenden Batterien.
1. Begriffe
Batterie nennt man eigentlich eine Zusammenschaltung mehrerer galvanischer Elemente oder Zellen. Es hat sich aber eingebürgert, auch eine einzelne Zelle als Batterie zu bezeichnen. Ein solches galvanisches Element besteht im wesentlichen aus zwei verschiedenen Metallen in einem Elektrolyten. Ist der Elektrolyt fest, zum Beispiel in einer Paste gebunden, so spricht man auch von einem Trockenelement.
Galvanische Elemente sind in der Regel Primärelemente, das heißt, sie geben eine Spannung ab, bis einer der beteiligten Stoffe verbraucht ist. Kann man diesen Vorgang rückgängig machen, in dem man eine Spannung an das Element anlegt, so spricht man von einem Sekundärelement oder Akkumulator.
(TOP)2. Geschichte
| -250 | 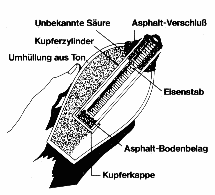 Die Parther benutzen eine Batterie, um metallische Gegenstände auf "galvanische" Weise zu vergolden.
(1800 Jahre vor Galvani!)
Die Parther benutzen eine Batterie, um metallische Gegenstände auf "galvanische" Weise zu vergolden.
(1800 Jahre vor Galvani!)
|
| 1789 | Der italienische Arzt Luigi Galvani (1737-1789) aus
Bologna hatte einen Froschschenkel an den Sehnen mit einem Kupferhaken an
den eisernern Stäben seines Fenstergitters aufgehangen und beobachtete, dass der Schenkel
jedes Mal zuckte, wenn er mit dem Eisenstäben in
Berührung kam. Die Beobachtung Galvanis und seine Erklärung, durch diese Beobachtung der
Lebenskraft auf die Spur gekommen zu sein, machte in wissenschaftlichen
Kreisen schnell die Runde. Diese enge Verbindung von Strom und Lebenskraft sollte sich für die nächsten hundert Jahre in den Köpfen der Menschen festsetzen. Man denke nur an Frankensteins Monster. |
| 1792 | 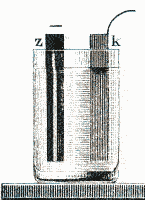 Graf Alessandro Volta
(1745-1827) aus Como, der in dieser Zeit (1780-1804) als Physiker an der Universität
von Pavia lehrte, erkannte durch systematische Versuche die eigentlichen
Voraussetzungen für die Entstehung des elektrischen Stromes, nämlich die
geschlossenen Kette Eisen, Kupfer und die salzhaltige Feuchtigkeit im
Froschschenkel. Seine erste Batterie, das sogenannte Voltasche Becherelement
von 1792, bestand aus einer Kupfer- und einer Zinkplatte, die ohne sich zu
berühren in leicht angesäuertem Wasser standen.
Graf Alessandro Volta
(1745-1827) aus Como, der in dieser Zeit (1780-1804) als Physiker an der Universität
von Pavia lehrte, erkannte durch systematische Versuche die eigentlichen
Voraussetzungen für die Entstehung des elektrischen Stromes, nämlich die
geschlossenen Kette Eisen, Kupfer und die salzhaltige Feuchtigkeit im
Froschschenkel. Seine erste Batterie, das sogenannte Voltasche Becherelement
von 1792, bestand aus einer Kupfer- und einer Zinkplatte, die ohne sich zu
berühren in leicht angesäuertem Wasser standen.
|
| 1800 |  Die erste brauchbare Batterie war dann 1800 die Voltasche Säule. Sie
bestand aus runden Scheiben von Kupfer und Zink, zwischen die eine mit einer
Flüssigkeit getränkte Filzscheibe gelegt wurde und die dann zu einer Säule
aufgeschichtet wurden.
Die erste brauchbare Batterie war dann 1800 die Voltasche Säule. Sie
bestand aus runden Scheiben von Kupfer und Zink, zwischen die eine mit einer
Flüssigkeit getränkte Filzscheibe gelegt wurde und die dann zu einer Säule
aufgeschichtet wurden. |
| 1815 | Professor Alois Ramis baut in München eine Serie elektrostatischer Uhren und benutzt als Energiequelle zwei Zambonische Säulen, eine Abwandlung der Voltaschen Säule. Dabei wurde unechtes Silberpapier (Zinn) und unechtes Goldpapier (Kupfer) mit der Papierseite zusammengeklebt und in großer Zahl aufeinandergelegt, so dass gleiches Metall stets nach der gleiche Seite liegt. Die in dem Papier enthaltene Feuchtigkeit wirkt dabei als Elektrolyt. |
| 1836 | Durch Veränderungen an der positiven Kupferelektrode des Voltaschen Elementes (Anlagerung von Wasserstoff
und Überzug mit metallischem Kupfer), ließ deren Spannung immer mehr
nach. Diese Polarisationserscheinungen wurden schon von Volta entdeckt und im Daniellschen
Element vermieden. John Frederic Daniell (1790-1845)
Professor für Chemie am Kings College in London, verwendete Kupfer- und
Zinkelektroden. Der positive Kupferstab steht in einer konzentrierten
Kupfersulfatlösung, der negative Zinkzylinder in einer verdünnten
Zinksulfatlösung. Beide Flüssigkeiten sind durch einen porösen Tonzylinder
getrennt. Bei Stromentnahme scheidet sich metallisches Kupfer am Kupferstab
ab, während sich die Zinkelektrode auflöst. Dadurch wird die
Zinksulfatlösung immer konzentrierter und die Kupfersulfatlösung immer
weiter verdünnt. Die innere Leitung übernehmen die negativen Sulfat Ionen,
die die Tonwand passieren können. Die Stromentnahme endet, wenn der Zinkpol
aufgelöst oder die Kupfersulfatlösung verbraucht ist. Bis dahin liefert das
Daniell Element eine konstante Klemmspannung (Spannung im unbelasteten
Zustand) von ziemlich genau 1V. Es gehört daher zu den konstanten
Elementen (kein Spannungsabfall durch Polarisationserscheinungen) und
wurde lange Zeit auch als Spannungsnormal verwendet.
John Frederic Daniell (1790-1845)
Professor für Chemie am Kings College in London, verwendete Kupfer- und
Zinkelektroden. Der positive Kupferstab steht in einer konzentrierten
Kupfersulfatlösung, der negative Zinkzylinder in einer verdünnten
Zinksulfatlösung. Beide Flüssigkeiten sind durch einen porösen Tonzylinder
getrennt. Bei Stromentnahme scheidet sich metallisches Kupfer am Kupferstab
ab, während sich die Zinkelektrode auflöst. Dadurch wird die
Zinksulfatlösung immer konzentrierter und die Kupfersulfatlösung immer
weiter verdünnt. Die innere Leitung übernehmen die negativen Sulfat Ionen,
die die Tonwand passieren können. Die Stromentnahme endet, wenn der Zinkpol
aufgelöst oder die Kupfersulfatlösung verbraucht ist. Bis dahin liefert das
Daniell Element eine konstante Klemmspannung (Spannung im unbelasteten
Zustand) von ziemlich genau 1V. Es gehört daher zu den konstanten
Elementen (kein Spannungsabfall durch Polarisationserscheinungen) und
wurde lange Zeit auch als Spannungsnormal verwendet.
|
| 1840 | Alexander Bain (1811-1877) baute seine elektrische Pendeluhr und benutzte als
Stromquelle zwei in den feuchten Boden vergrabene Metallplatten
(Zink-Kupfer).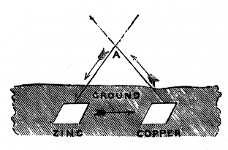 "If we place a sheet of zinc and another of copper in the ground a
little distance from each other, and a few feet deep, so that they are
perfectly imbedded in the moist soil, we have, by this simple arrangement,
a source of electricity, and if the sheets of metal are about two square
feet each we shall have amply sufficient to work a clock." (Alexander Bain: A Short History of the Electric Clock [Bain1852]) "If we place a sheet of zinc and another of copper in the ground a
little distance from each other, and a few feet deep, so that they are
perfectly imbedded in the moist soil, we have, by this simple arrangement,
a source of electricity, and if the sheets of metal are about two square
feet each we shall have amply sufficient to work a clock." (Alexander Bain: A Short History of the Electric Clock [Bain1852]) |
| 1868 |  Der Franzose Georges Leclanché (1839-1882)
entwickelte 1868 die nach ihm benannte Braunstein-Zelle, die bis heute das
gebräuchlichste Primärelement ist. Ein Kohlestab umgeben von Mangansuperoxyd
(Braunstein, MnO2) als positive Elektrode steckt in einem
Tonzylinder. Dieser wiederum steht in einem Gefäß mit Salmiakgeist (NH4Cl),
in den ein Zinkstab als negative Elektrode eintaucht.
Der Franzose Georges Leclanché (1839-1882)
entwickelte 1868 die nach ihm benannte Braunstein-Zelle, die bis heute das
gebräuchlichste Primärelement ist. Ein Kohlestab umgeben von Mangansuperoxyd
(Braunstein, MnO2) als positive Elektrode steckt in einem
Tonzylinder. Dieser wiederum steht in einem Gefäß mit Salmiakgeist (NH4Cl),
in den ein Zinkstab als negative Elektrode eintaucht.Später wurde der Tonzylinder durch einen Gespinstbeutel ersetzt und der Zinkstab durch einen Zinkzylinder. Wenn man jetzt noch die Salmiaklösung durch Kleister eindickt, so erhält man unsere heutige Trockenzelle. |
| 1940 | Der Amerikaner Rubens entwickelt die Quecksilberbatterie, die in der Folge genügend miniaturisiert werden kann, um in einer Armbanduhr Platz zu finden. |
| 1952 | Die ersten Kopfzellen für Uhren erscheinen. Es sind Nickel-Kadmium-Batterien, die für die ersten elektrischen Armbanduhren (LIP, ELGIN) verwendet werden. |
| 1960 | Die ersten Quecksilber- und Silberoxyd-Kopfzellen erscheinen. |
3. Galvanisches Element
Bringt man ein Metall in ein Lösungsmittel, so gehen positive Metallionen aus dem Gitterverband in Lösung. Es bildet sich ein elektrisches Feld zwischen dem nun negativen Metall und der positiven Ionenwolke aus (Doppelschicht), welches das weitere Auflösen des Metalls verhindert. Die Lösungstension (d.h. da Bestreben eines Metalls in Lösung zu gehen) ist abhängig von der bei der Abtrennung des Metallions aus dem Metallgitter gewonnenen Energie, genauer: von der Differenz der Hydrationsenergie und der Gitterenergie des Ions. Daher ist auch das elektrische Feld der Doppelschicht bzw. seine Spannung abhängig von der Lösungstension, d.h. vom Metall und dem Lösungsmittel.
Bring man zwei verschiedene Metalle (Metallelektroden, z.B. Kupfer = Cu und Zink = Zn) in den gleichen Elektrolyten, so bildet sich an beiden Elektroden eine Doppelschicht wie oben beschrieben aus. Die einzelnen Spannungen der Doppelschichten (Metall-Lösungsmittel) sind nicht messbar, wohl aber ihre Differenz. Man misst daher zwischen den beiden Elektroden eine elektrische Spannung. Eine solche Anordnung heißt Galvanisches Element und seine Spannung ist die Differenz der Einzelspannungen der Elektroden gegen den Elektrolyten.
Verbindet man die beiden Elektroden mit einem Metalldraht, so fließen Elektronen von der negativen Elektrode (Anode, Zn) zur positiven (Kathode, Cu), da sich die Ladungen an den Elektroden versuchen auszugleichen. Ein solches Element kann dann in diesem äußeren Stromkreis elektrische Arbeit verrichten. Der innere Strom wird dabei von den Metallionen (Zn++) getragen, mit der Folge, dass sich die Anode (Zn) auflöst und die Kathode (Cu) sich mit den entladenen Metallionen (Zn) überzieht. Solche Erscheinungen führen dazu, dass die Spannung des Elements sinkt und der Stromfluss schon vor der Auflösung der Anode zum Erliegen kommt. Alle diese Erscheinungen nennt man Polarisation und müssen für eine praktikable Batterie verhindert werden. (TOP)
4. Zink-Braunstein Elemente
Die heute meist verwendeten Primärbatterien basieren auf dem Zink-Braunstein Element, fälschlich auch Zink-Kohle Batterie genannt. Gemeinsam ist allen diesen Elementen eine Zink Anode und eine Mangandioxyd Kathode (MnO2, Braunstein) In der ursprüngliche Form (Leclanché Element) wurde ein wässriger Ammoniak Elektrolyt verwendet. Später wurde er dann mit Weizenmehlkleister eingedickt und es entstand die bekannte Form der Trockenbatterie. Heute verwendet man andere Elektrolyten: Zinkchlorid (ZnCl2) für einfache Batterien und Kalilauge (KOH) bei den Alkali-Mangan Batterien.
4.1 Leclanché Element
Eine Leclanché Rundzelle besteht aus einem Zinkbecher als negativer Elektrode und einem Braunsteinzylinder mit Kohlestab (die sogenannten Puppe) als positiver Elektrode. Dazwischen befindet sich der eingedickte Ammoniak-Elektrolyt. Früher wurde die Zelle mit einem Pappmantel zur Aufnahme eventuell austretender Reaktionsprodukte versehen. Heute wird meist ein Stahlbecher benutzt (Leak Proof).
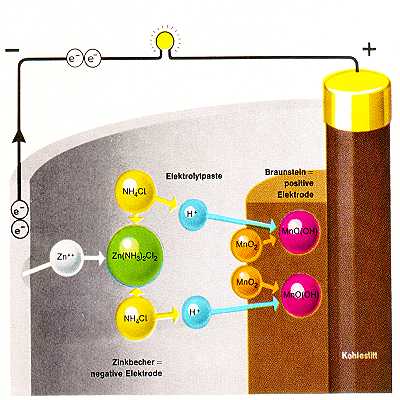
Die chemische Reaktion ist im wesentlichen eine Oxidation des Zinks und eine Reduktion des Braunsteins. Die Einzelreaktionen sind sehr kompliziert und unterscheiden sich je nach der Entladeart:
Harte Entladung: Hoher Strom über kurze Zeit
Zn + 2MnO2 +2NH4Cl -> Zn(NH3)2Cl2 + 2MnO(OH)
Der Elektrolyt verhärtet.
Weiche Entladung: Geringer Strom
Zn + 2MnO2 +2NH4Cl -> ZnCl2 + 2NH3
+ Mn2O3 + H2O
Der Elektrolyt bleibt weich.
Die Reaktion endet ("die Batterie ist leer"), wenn der Braunstein verbraucht ist. Der Zinkbecher ist ist dann immer noch nicht aufgelöst. Die Kapazität der Batterie (ihr Energieinhalt) ist also direkt abhängig von der Menge des Braunsteins. Man versucht daher, das Volumen der Puppe auf Kosten des Elektrolyten zu erhöhen. Dies geht aber nur bis zu einem bestimmten Grad, da sonst vermehrt unerwünschte Reaktionsprodukte einer Elektrode zur anderen wandern und so einen inneren Kurzschluss verursachen. Dies erhöht die Selbstentladung und damit die Lagerfähigkeit der Batterie bzw. die Lebensdauer bei geringer Stromentnahme. Allerdings verringert eine dünne Elektrolytschicht den Innenwiderstand der Batterie, was für die Entnahme hoher Ströme wichtig ist. Dem Braunstein wird immer eine gewisse Menge Aktivkohle zur Verringerung des Innenwiderstandes beigemengt, welches aber auch Kapazität verringert. Für unterschiedliche Anwendungsfälle wird man also bestimmte Kompromisse zwischen Kapazität, Innenwiderstand und Selbstentladung eingehen müssen. Bei Uhren ist der Stromverbrauch relativ gering, die Lebensdauer sollte aber besonders hoch sein. Wichtiger als der Innerwiderstand und auch die Kapazität ist daher die Selbstentladung, die über die vorgesehene Laufzeit der Uhr mit einer Batterie vernachlässigbar sein muss.
4.2 Zinkchlorid
Um den Innenwiderstand des Leclanchè-Elements weiter zu senken, wurde häufig eine Mischung aus Ammoniak und Zinkchlorid als Elektrolyt verwendet. Bei der Zinkchlorid-Zelle ist nun reines Zinkchlorid, auf Papier aufgestrichen, zwischen dem Zinkbecher und der Braunsteinpuppe angebracht. Deren Volumen und damit die Kapazität der Batterie konnte dadurch erheblich erhöht werden. Das Papier wirkt außerdem als sogenannter Scheider und verhindert ein unerwünschtes Wandern von Ionen in der Zelle und verringert damit die Selbstentladung. Bei der chemischen Reaktion entsteht kein Wasser, daher ist diese Batterie relativ auslaufsicher. Allerdings muss auch ein erhöhter Dichtungsaufwand gegen Austrocknen getrieben werden.
Die hauptsächliche Reaktion in der Zelle ist:
4Zn + 8MnO2 + ZnCl2 + 9H2O ->
ZnCl2*4ZnO*5H2O + 8MnO(OH)
Das Zinkchlorid-Element hat eigentlich nur Vorteile gegenüber dem klassischen Leclanché-Element, ist aber leider in der Herstellung teurer.
4.3 Alkali-Mangan
 Diese
Zelle unterscheidet sich im Aufbau von den obengenannten. Hier ist der
Braunstein nicht im Zentrum angeordnet, sondern an der Außenwand. Als
Elektrolyt wird Kalilauge (KOH) verwendet.
Diese
Zelle unterscheidet sich im Aufbau von den obengenannten. Hier ist der
Braunstein nicht im Zentrum angeordnet, sondern an der Außenwand. Als
Elektrolyt wird Kalilauge (KOH) verwendet.
Da die Zinkelektrode in dem stark alkalischen Elektrolyten sehr schnell korrodieren würde, muss sie wesentlich stärker amalgamiert (Behandlung mit Quecksilber) werden. Dadurch tritt aber bei starken Strömen eine Passivierung der Zink-Oberfläche auf, die den Innenwiderstand erhöht. Dem wird durch eine wesentliche Vergrößerung der Zinkoberfläche durch die Verwendung von Zinkpulver begegnet. Dieses befindet sich mit dem Elektrolyten vermenget, im Zentrum der Zelle.
Die chemische Reaktion in der Zelle ist:
Zn + 2MnO2 +2KOH + 2H2O-> [Zn(OH)4]K2
+ 2MnO(OH)
Die Alkali-Mangan Zelle hat eine wesentlich höhere spezifische Kapazität als die vorgenannten Braunsteinzellen und einen nochmals verringerten Innenwiderstand. Ihre Herstellung ist aber auch erheblich teurer. Heute wird die Zelle quecksilberfrei hergestellt. Auf die Amalgamierung konnte (wie auch immer) verzichtet werden.
(TOP)5. Andere Elemente
5.1 Zink-Luft (Luftsauerstoff)
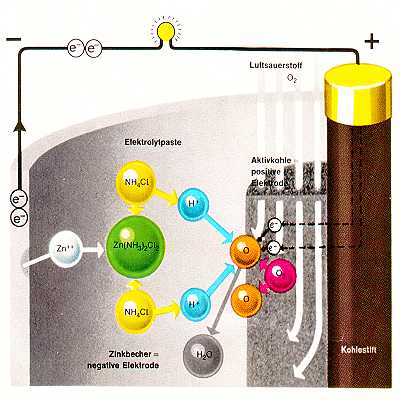
Anstelle von Braunstein wird hier Aktivkohle verwendet, welche die Eigenschaft hat, Gase und damit auch Luftsauerstoff zu absorbieren und reaktionsfähig zu machen. Ihr Vorteil liegt in der langen Lagerfähigkeit (geringe Selbstentladung) sowie der konstanten Entladespannung bei niedrigen Strömen. Sie wurde zunächst nur als Großelement hergestellt (siehe ATO Elemente), später aber auch als Knopfzelle. Eigentlich sind diese ideal für Armbanduhren (geringe Selbstentladung, hohe spezifische Kapazität). Leider sind Uhrgehäuse gewöhnlich wasser- und damit auch luftdicht, sodass solche Batterien nur für Hörgeräte eingesetzt werden.
6. Bauformen und Abmessungen
6.1 Rundzellen
| Rundzellen | |
|---|---|
| Bezeichnung | Abmessung |
| Mono-Zelle, IEC R20, IEC LR20 | Ø34mm Höhe 61mm |
| Baby-Zelle, IEC R14, IEC LR14 | Ø26mm Höhe 50mm |
| Mignon-Zelle, IEC R06, IEC LR06 | Ø14mm Höhe 50mm |
| Micro-Zelle, IEC R03, IEC LR03 | Ø10,5mm Höhe 44,5mm |
| Lady-Zelle, IEC R01, IEC LR01 | Ø12mm Höhe 30mm |
6.2 ATO Batterien

| ATO Batterien (nach [Flume1957/1]) | |
|---|---|
| Bezeichnung | Abmessungen |
| ATO 1 | Höhe 150mm, Länge 92mm, Breite 48mm |
| ATO 5 | Höhe 95mm, Länge 70mm, Breite 35mm |
| ATO 9 (8), Kundo 825 | Höhe 100mm, Länge 80mm, Breite 20mm |
| ATO 10 (3) | Höhe 100mm, Länge 38mm, Breite 38mm |
6.3 Knopfzellen

| Kopfzellen (in der Abbildung von links nach rechts) |
|
|---|---|
| Bezeichnung | Abmessung |
| Lithium: CR1220 | Ø12mm Höhe 2,0mm |
| Lithium: CR2016 | Ø20mm Höhe 1,6mm |
| Lithium: CR2430 | Ø24mm Höhe 3,0mm |
| Silberoxyd: SR416SW | Ø4,9mm Höhe 1,6mm |
| Silberoxyd: SR721SW | Ø7,9mm Höhe 2,1mm |
| Silberoxyd: SR1154SW | Ø11,9mm Höhe 5,4mm |
7. Batterien für alte Uhren
Als Sammler alter elektrischer Uhren, der diese auch in Funktion sehen und präsentieren möchte, steht man häufig vor dem Problem, dass die Originalbatterien nicht mehr hergestellt werden. Die sogenannten ATO-Batterien sind beispielsweise seit Jahren nicht mehr lieferbar. Für dieses Problem gibt es eine Reihe unterschiedlicher Lösungsansätze.
 Auf Uhrenbörsen findet man häufig Uhren, bei denen ein neuer
Batteriehalter aus dem Bastlerladen einfach an die bestehenden
Batteriekontakte angelötet ist. Dies ist, auch wenn er nicht sichtbar
sein sollte, natürlich völlig indiskutabel und sollte schnellstens
wieder entfernt werden.
Auf Uhrenbörsen findet man häufig Uhren, bei denen ein neuer
Batteriehalter aus dem Bastlerladen einfach an die bestehenden
Batteriekontakte angelötet ist. Dies ist, auch wenn er nicht sichtbar
sein sollte, natürlich völlig indiskutabel und sollte schnellstens
wieder entfernt werden.
Für die "Kundo 825" Batterie (ATO 10), gibt (oder gab) es eine Ersatzbatteriehalterung in der gleichen Abmessung zu kaufen (Flume ca. 10EUR). In diese Halterung konnte eine Mignonzelle eingesetzt werden. Weitere käufliche Ersatzmöglichkeiten sind mir nicht bekannt.
 Wenn noch eine alte, leere Batterie vorhanden ist, so kann man sie
vorsichtig zerlegen, aushöhlen und eine Batterie bzw. einen
Batteriehalter einlöten. Eventuell lassen sich die vorhanden
Batteriekontakte direkt weiterverwenden. Ist keine alte Batterie mehr
greifbar, so kann man eine Attrappe aus Holz oder Pertinax nachbauen. Wenn
diese dann mattschwarz lackiert wird, sieht sie einer Luftsauerstoffzelle
zumindest ähnlich.
Wenn noch eine alte, leere Batterie vorhanden ist, so kann man sie
vorsichtig zerlegen, aushöhlen und eine Batterie bzw. einen
Batteriehalter einlöten. Eventuell lassen sich die vorhanden
Batteriekontakte direkt weiterverwenden. Ist keine alte Batterie mehr
greifbar, so kann man eine Attrappe aus Holz oder Pertinax nachbauen. Wenn
diese dann mattschwarz lackiert wird, sieht sie einer Luftsauerstoffzelle
zumindest ähnlich.
 Eine einfacher Ersatz für eine
Batterie mit Schraubanschluss, zum
Beispiel für meine Bulle-Clockette möchte ich nun präsentieren. Die
Originalbatterie war wahrscheinlich eine Luftsauerstoff-Zelle ähnlich der
ATO 3 mit quadratischem Querschnitt. Als Ersatz wird
eine Mono-Zelle benutzt, die einen
vergleichbaren Durchmesser hat, aber erheblich kürzer ist. Sie wird mit
mattem Tesaband umwickelt, was ihr ein ähnliches Aussehen, wie das einer
Luftsauerstoffbatterie verleiht. Auf dem Pluspol wird eine Messingmutter
der Größe M3 aufgelötet. Der Minuspol muss nun auch nach oben geführt
werden. Dies geschieht mit einem durchbohrten Messingrundstab
(sogenanntem Futterdraht) mit dem Durchmesser 5mm. Dieser hat eine Bohrung
von 2,5mm, so dass einfach ein M3 Gewinde hineingeschnitten werden kann.
Dieser passend gekürzte Futterdraht wird nun seitlich mit Tesaband an der
Monozelle befestigt und mit dem Batterieboden mittels eines kurzen Drahtes
verbunden.
Eine einfacher Ersatz für eine
Batterie mit Schraubanschluss, zum
Beispiel für meine Bulle-Clockette möchte ich nun präsentieren. Die
Originalbatterie war wahrscheinlich eine Luftsauerstoff-Zelle ähnlich der
ATO 3 mit quadratischem Querschnitt. Als Ersatz wird
eine Mono-Zelle benutzt, die einen
vergleichbaren Durchmesser hat, aber erheblich kürzer ist. Sie wird mit
mattem Tesaband umwickelt, was ihr ein ähnliches Aussehen, wie das einer
Luftsauerstoffbatterie verleiht. Auf dem Pluspol wird eine Messingmutter
der Größe M3 aufgelötet. Der Minuspol muss nun auch nach oben geführt
werden. Dies geschieht mit einem durchbohrten Messingrundstab
(sogenanntem Futterdraht) mit dem Durchmesser 5mm. Dieser hat eine Bohrung
von 2,5mm, so dass einfach ein M3 Gewinde hineingeschnitten werden kann.
Dieser passend gekürzte Futterdraht wird nun seitlich mit Tesaband an der
Monozelle befestigt und mit dem Batterieboden mittels eines kurzen Drahtes
verbunden.
ACHTUNG: Der von Edward Hanson [Hanson1988] publizierte Vorschlag (für eine Brillié-Pendeluhr), den Batteriebecher als Minuspol zu benutzen, indem er mit dem Boden der Batterie verlötet wird, funktioniert zumindest für Alkali-Mangan Batterien nicht. Dort ist der Batteriebecher schon mit dem Pluspol der Batterie verbunden und ein Verlöten mit dem Boden würde einen Kurzschluss bedeuten.
 Für die
Brillié-Uhr lässt sich aber auch relativ einfach eine
Ersatzbatterie bauen. Eine Abbildung
der Originalbatterie ist bei [Techen1987]
zu sehen Es handelte sich dabei wohl um eine Nasszelle in einem
runden, transparentem Becher. Der eine Batteriekontakt war eine
rechteckige Platte, der mit der negativem Zinkelektrode der Batterie
verbunden war. Der andere Kontakt war die zentrisch angeordnete
Kohleelektrode.
Für die
Brillié-Uhr lässt sich aber auch relativ einfach eine
Ersatzbatterie bauen. Eine Abbildung
der Originalbatterie ist bei [Techen1987]
zu sehen Es handelte sich dabei wohl um eine Nasszelle in einem
runden, transparentem Becher. Der eine Batteriekontakt war eine
rechteckige Platte, der mit der negativem Zinkelektrode der Batterie
verbunden war. Der andere Kontakt war die zentrisch angeordnete
Kohleelektrode.
Für die Ersatzbatterie wurden zwei Messingbleche passender Abmessung mit
zwei Rundmessingstücken (Futterdraht) verschraubt. Innen auf das untere
Blech wurde eine Kontaktfeder aus einem Batteriekasten geschraubt. In das
obere Blech wurde eine Messingschraube ISOLIERT angebracht. Die Monozelle
dazwischen musste leider noch mit einem Kabelbinder (gibt es auch in
schwarz) befestigt werden. Diese Anordnung lässt sich nun in die
vorgesehene Halterung der Brillié einschieben.
8. Literatur
- Das Primärelement Trockenbatterie
Eine physikalische Plauderei über Batterien
Hrsg. VARTA Pertrix-Union GmbH, Frankfurt 1967 - Lithium-Batterien für die Elektronik
Hrsg. VARTA Batterie AG, Hannover 1983 - F. Schmidt, A. Trinkle: Batterien und ihre Anwendung in Uhren
Uhrentechnik - D. Spahrbier: Elektrochemische Systeme zur Energieversorgung
elektronischer Armbanduhren
UJS 12/82 - Vor 2000 Jahren schon Trockenbatterien?
UJS 82-19/79 - Uhrenbatterien - Entwicklung, Funktion, Probleme
Hrsg. Longines, Francillon S.A, in Uhren & Schmuck Sonderheft Technik I, 4/1983 - dtv-Lexikon der Physik, München 1970
- dtv-Atlas Physik, München 20005
- Gerthsen, Kneser, Vogel: Physik, Berlin 197412
| Glaser1974 | Allgemeines zu Batterien und Battereiprüfungen |
| Saunier1915 | Alles über alte Batterien |